Informatics Educational Institutions & Programs
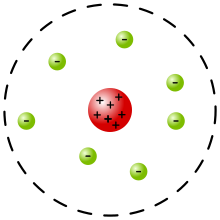
Das rutherfordsche Atommodell von 1911 beschreibt erstmals das Atom als einen außerordentlich kleinen, positiv geladenen Atomkern, der fast die ganze Masse des Atoms besitzt, und von einer leichten Atomhülle aus negativ geladenen Elektronen umgeben ist. Das Atommodell wurde von Ernest Rutherford aufgestellt. Es überwand das 1904 aufgestellte thomsonsche Atommodell und wurde seinerseits 1913 weiter ausgestaltet zum Bohrschen Atommodell, mit dem die Energiestufen der Atomhülle erstmals erfolgreich beschrieben werden konnten. Damit bildet das rutherfordsche Atommodell die Grundlage für das heutige Bild vom Atom und insbesondere für dessen Aufbau mit einem Kern einerseits und einer Hülle um den Kern (Kern-Hülle-Modell).
Überblick
Bis zum rutherfordschen Streuversuch (1909) von Hans Geiger, Ernest Marsden und Ernest Rutherford war lediglich bekannt, dass Atome negativ geladene Elektronen und die gleiche Menge positiver Ladungen enthalten. Einen dazu passenden Erklärungsversuch für den Atomaufbau stellte das thomsonsche Atommodell dar, wonach jedes Atom aus einer gleichmäßig verteilten positiven Ladung bestünde, in der sich unter der Wirkung elektrostatischer Kräfte die Elektronen bewegten. Der rutherfordsche Streuversuch zeigte, dass dieses Modell nicht die Realität abbildet. Die Gesamtheit der positiven Ladungen des Atoms und praktisch seine gesamte Masse müssen in einem Atomkern vereinigt sein, dessen Größe nur einen winzigen Bruchteil des gesamten Atoms ausmacht.[1]
Der Versuch
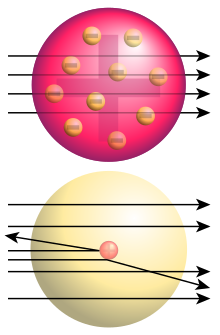
Rutherfords Mitarbeiter Hans Geiger und Ernest Marsden führten Versuche mit energiereichen Alpha-Teilchen der natürlichen Radioaktivität von Wismut-214 durch. Zunächst wurde beobachtet, dass einige wenige der Alpha-Teilchen von einer Platinplatte zurückgeworfen wurden.[2] Das war völlig unerwartet, denn bisher hatte man lediglich Ablenkungen der Alpha-Teilchen um wenige Grad festgestellt, und es war mit bisherigen Vorstellungen vom Atom auch nicht zu erklären.
In einem verfeinerten Versuchsaufbau wurde im Vakuum mit dünnen Folien verschiedener Metalle, darunter Gold, die Häufigkeitsverteilung von Ablenkwinkeln zwischen 15° und 170° untersucht.[3] Auch hier zeigte sich, dass wesentlich größere Ablenkwinkel auftraten, als durch den Zusammenstoß der Alphateilchen mit den vergleichsweise sehr leichten Elektronen erklärbar sind, und dass etwa eines von 8000 Alphateilchen ganz zurückgeworfen wurde.
“It was almost as incredible as if you fired a 15-inch shell at a piece of tissue paper and it came back and hit you.”
„Es war beinahe so unglaublich, als ob man mit einem 15-Zoll-Geschoss auf ein Taschentuch schießt und das Geschoss zurückkommt und einen selbst trifft.“
Das Modell von Rutherford
Aus der neu konzipierten Vorstellung, im Atom gäbe es einen kleinen, schweren, elektrisch geladenen Kern, leitete Rutherford die nach ihm benannte Streuformel her. Damit konnte die beobachtete Häufigkeit großer Ablenkwinkel erklärt werden, wenn der Kernradius nicht größer als 1/3000 des Atomradius ist und seine elektrische Ladung (in Einheiten der Elementarladung) in etwa der chemischen Ordnungszahl des Atoms entspricht.[5]
Mit dem Streuversuch lässt sich nicht unterscheiden, ob das Vorzeichen der elektrischen Ladung des schweren Kerns positiv oder negativ ist. Zur Erklärung der elektrischen Neutralität von Atomen ging Rutherford davon aus, dass die Elektronen eine negativ geladene Hülle um den positiv geladenen Kern bilden, so dass das Atom nach außen neutral ist. Er bemerkte auch, dass mit dem positiven Vorzeichen der Kernladung eine Erklärung der großen kinetischen Energie der α-Teilchen in der radioaktiven Strahlung möglich werden könnte, wenn diese in der Nähe des Kerns freigesetzt und dann nur noch elektrostatisch abgestoßen würden. Über die räumliche Verteilung der Elektronen ließen sich aus dem Streuversuch keine weiteren Informationen ableiten, da die Elektronen aufgrund ihrer geringen Masse zur Ablenkung der Alphateilchen um große Winkel nicht merklich beitragen. Entgegen häufig zu findenden Darstellungen in Lehrbüchern und anderen Sekundärquellen entwickelte Rutherford kein eigenes Modell der Elektronenstruktur von Atomen. Er zitierte lediglich im Februar 1911 bei der Vorstellung seines Modells vor der Manchester Literary and Philosophical Society[5] das „planetarische Modell“ von Nagaoka[6], um seine Abschätzung der Kernladungszahl von Gold plausibel zu machen.
Weitere Entwicklungen
Das Modell von Rutherford blieb zunächst weitgehend unbeachtet. Das änderte sich erst, als Niels Bohr auf dieser Grundlage 1913 sein Atommodell vorstellte und damit bei der Erklärung der Bewegungen der Elektronen in der Atomhülle einen Durchbruch erzielte. Dann wurde durch Henry Moseley schnell gezeigt, dass die innersten Bohrschen Bahnen eine genaue Erklärung für die charakteristische Röntgenstrahlung geben konnten, wodurch die positive Kernladung und damit die chemische Ordnungszahl direkt messbar gemacht wurde. Aus der weiteren Erforschung der Atomkerne entwickelte sich die Kernphysik, aus der der Atomhülle die eigentliche Atomphysik. Als nach und nach immer mehr Unzulänglichkeiten des Bohrschen Atommodells zu Tage traten, wurde es durch die 1925 entdeckte Quantenmechanik abgelöst, die zu Grundlage fast der gesamten modernen Physik wurde. So wurde auch 1928 durch George Gamow erklärt, wie die α-Teilchen mittels des quantenmechanischen Tunneleffekts den Kern verlassen können und anschließend, wie von Rutherford angenommen, durch elektrostatische Abstoßung ihre große kinetische Energie gewinnen.
Siehe auch
Einzelnachweise
- ↑ Dieter Meschede: Gerthsen Physik. 21. Auflage. Springer, Heidelberg / Dordrecht / London / New York 2002, ISBN 978-3-662-07461-9, S. 621, doi:10.1007/978-3-642-12894-3.
- ↑ Jörn Bleck-Neuhaus: Elementare Teilchen. Von den Atomen über das Standard-Modell bis zum Higgs-Boson. 2., überarbeitete Auflage. Springer, 2013, ISBN 978-3-642-32578-6, ISSN 0937-7433, S. 49, doi:10.1007/978-3-642-32579-3.
- ↑ Hans Geiger, Ernest Marsden: On a Diffuse Reflection of the α-Particles. In: Proceedings of the Royal Society. 82A. Jahrgang, 1909, S. 495–500 (chemteam.info [abgerufen am 25. Oktober 2010]).
- ↑ Edward Andrade: Rutherford and the Nature of the Atom. Doubleday New York 1964. Zitiert nach: Laylin K. James: Nobel Laureates in chemistry, 1901–1992, S. 57
- ↑ a b E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Phil. Mag. 6, vol. 21, 669–688 (1911). Rutherfords Artikel im Philosophical Magazine (englisch, PDF; 233 kB) (Memento vom 15. Mai 2019 im Internet Archive)
- ↑ Hantarō Nagaoka: Kinetics of a system of particles illustrating the line and the band spectrum and the phenomena of radioactivity. In: Philosophical Magazine. 7. Jahrgang, 1904, S. 445–455 (chemteam.info [abgerufen am 28. Februar 2010]).
















