Informatics Educational Institutions & Programs
Contingut
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 150,22 g/mol |
| Trobat en el tàxon | Lindera erythrocarpa, tanarida, Ridolfia segetum, Artemisia judaica, Conyza bonariensis, Mentha canadensis, pebreta, pastanaga, Taronger trifoliat, Satsuma, mandariner, Mentha crispa, Aranja grossa, Cyperus, Citrus × deliciosa, Citrus grandis, Mentha piperita, Litsea glaucescens, serrana rodona, cúrcuma, Mentha arvensis, menta borda, botja pudent, Salvia triloba, Salvia fruticosa, Erigeron bonariensis, Tanacetum balsamita, Tanacetum balsamitoides, Balsamita major, Eremophila oppositifolia, Melaleuca rhaphiophylla, Xanthorrhoea preissii, Flindersia schottiana, Zanthoxylum ovalifolium, Eucalyptus camfieldii, Lagarostrobos franklinii, Callitris hugelii, Callitris columellaris, Callitris glaucophylla, Santalum lanceolatum, Atherosperma moschatum, Hedycarya angustifolia, Doryphora sassafras, Cinnamomum oliveri, Zieria smithii, Geijera parviflora, Boronia ledifolia, Boronia thujona, Backhousia angustifolia, Backhousia myrtifolia, Eucalyptus dives, Eucalyptus caesia, Eucalyptus flocktoniae, Hysterobaeckea behrii, Darwinia citriodora, Eremophila mitchellii, Artemisia maritima i menta boscana |
| Rol | agents antineoplàstics fitògens |
| Estructura química | |
| Fórmula química | C₁₀H₁₄O |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 0,965 g/cm³ (a 15 °C, líquid) |
| Índex de refracció | 1,5003 (a 20 °C) |
| Punt de fusió | 25,2 °C |
| Punt d'ebullició | 230 °C (a 755 Torr) |
| Pressió de vapor | 0,115 Torr (a 25 °C) |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () Sistema globalment harmonitzat de classificació i etiquetatge de productes químics (GHS) (GHS07: signe d'exclamació) | |
La carvona és una cetona monoterpenoide cíclica que es troba de manera natural en molts olis essencials, essent majoritària en els olis de llavors d'alcaravia (Carum carvi), de menta verda (Mentha spicata) i d'anet.[1]
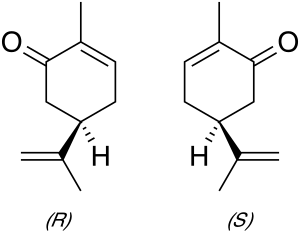
La carvona presenta dos estereoisòmers que es troben a la natura i que tenen propietats organolèptiques diferenciades: l'enantiòmer R, present en l'oli essencial de menta, fa olor mentolada, mentre que l'enantiòmer S, majoritari en l'oli d'alcaravia, té una aroma picant. A causa d'aquestes propietats, ambdós estereoisòmers són emprats a la indústria alimentària i cosmètica. A més, se n'ha descrit l'ús com a repel·lent d'insectes o com a precursor en síntesi orgànica asimètrica, entre altres.
A escala industrial, la carvona s'obté o bé per destil·lació fraccionada dels olis essencials que la contenen de forma majoritària, o bé de forma semisintètica a partir d'altres monoterpens, com el limonè.
Història
Els antics romans empraven l'alcaravia per a usos medicinals,[1] però probablement la carvona no es va aïllar com a compost pur fins que Franz Varrentrapp (1815-1877) l'obtingué el 1849.[2] Prèviament, el 1841, el químic suís Eduard Schweizer (1818-1860) l'havia identificat anomenant-la «carvol».[3] Goldschmidt i Zürrer la van identificar com una cetona relacionada amb el limonè,[4] i finalment Georg Wagner (1849-1903) n'elucidà l'estructura el 1894.[5]
Propietats
Propietats físiques
La carvona és un líquid d'un color groc pàl·lid amb un punt d'ebullició de 230 °C. És soluble en alcohol o cloroform.
Estereoisomerisme
La carvona presenta dos enantiòmers: la R-(-)-carvona, o levo-carvona, té una olor dolça i mentolada, com les fulles de menta. La seva imatge especular, S-(+)-carvona, o dextro-carvona, té un aroma picant amb notes de sègol, com les llavors d'alcaravia.[6][7] El fet que els dos enantiòmers es percebin amb olor diferent és una prova que els receptors olfactius han de contenir grups quirals, permetent-los respondre de forma més intensa a un enantiòmer que a l'altre, encara que no tots els enantiòmers tenen olors distingibles. S'ha vist que la mona esquirol és capaç de discernir entre els dos enantiòmers de la carvona.[8]
Reactivitat
La carvona té tres enllaços dobles capaços de reduir-se; el producte de reducció depèn dels reactius i de les condicions utilitzades.[2] La hidrogenació catalítica de la carvona (1) pot donar carvomentol (2) o carvomentona (3). El zinc i l'àcid acètic redueixen la carvona per donar dihidrocarvona (4). La reducció de Meerwein-Ponndorf-Verley mitjançant propan-2-ol i isopropòxid d'alumini redueix només el grup carbonil per proporcionar carveol (5); també és eficaç una combinació de borohidrur de sodi i CeCl₃ (reducció de Luche). La hidrazina i l'hidròxid de potassi donen limonè (6) mitjançant una reducció de Wolff-Kishner.

L'oxidació de la carvona també pot generar una varietat de productes.[2] En presència d'un àlcali com ara Ba(OH)₂, la carvona s'oxida per l'aire o l'oxigen per donar la dicetona 7. Amb el peròxid d'hidrogen es forma l'epòxid 8. La carvona es pot escindir amb ozó seguit de vapor, donant la dilactona 9, mentre que el KMnO₄ dona 10.

Com a cetona α,β-insaturada, la carvona sofreix addicions conjugades de nucleòfils. Per exemple, la carvona reacciona amb dimetilcuprat de liti per situar un grup metil trans al grup isopropenil amb bona estereoselectivitat. L'enolat resultant es pot al·lilar amb bromur d'al·lil per donar la cetona corresponent.[9]

Quan es tracta amb un àcid fort, isomeritza a carvacrol, que és un fenol monoterpenoide.[10][11]
Ocurrència
La S-(+)-carvona és el constituent principal (60-70%) de l'oli de les llavors d'alcaravia (Carum carvi),[12] que es produeix a una escala d'unes 10 tones anuals.[1] També constitueix al voltant d'un 40-60% de l'oli de llavors d'anet (Anethum graveolens) i també en oli de pell de la mandarina.
La R-(-)-carvona és també el compost més abundant en l'oli essencial de diverses espècies de menta, en especial l'oli de menta verda (Mentha spicata), que conté al voltant del 50-80% de R-(-)-carvona. la menta és una important font de R-(-)-carvona produïda de manera natural. L'isòmer R-(-)-carvona també es troba en l'oli de kuromoji.
Alguns olis, com l'oli de palmarosa, contenen una barreja d'ambdós enantiòmers. Molts altres olis naturals, per exemple l'oli de menta pebrera, contenen quantitats de carvones a nivell de traces.
Obtenció i síntesi
La forma dextro, S-(+)-carvona, s'obté pràcticament pura per la destil·lació fraccionada de l'oli d'alcaravia. La forma levo obtinguda a partir dels olis que la contenen requereixen generalment un tractament addicional per produir R-(-)-carvona d'alta puresa. Això es pot aconseguir mitjançant la formació d'un compost d'addició amb sulfur d'hidrogen, a partir del qual es pot regenerar la carvona mitjançant tractament amb hidròxid de potassi en etanol i destil·lació del producte en un corrent de vapor.
Tanmateix, la majoria de R-(-)-carvona emprada en aplicacions comercials es sintetitza a partir de R-(+)-limonè.[10] El tractament del limonè amb clorur de nitrosil produeix nitrosoclorur de limonè mitjançant l'addició al doble enllaç de l'anell seguint la regla de Markóvnikov. Aquest compost es converteix en carvoxima refluxant-lo amb piridina en acetona. El reflux de la carvoxima amb un 5% d'àcid oxàlic produeix carvona.[13]

La gran disponibilitat de pells de taronja, com a subproducte en la producció de suc de taronja, ha fet que el limonè estigui disponible a bon preu i, conseqüentment, la carvona sintètica s'obtingui a un preu econòmic.[14]
La biosíntesi de la carvona es produeix per oxidació del limonè.
Usos
Ambdós enantiòmers s'utilitzen a la indústria alimentària i de les aromes.[1] La R-(−)-carvona també s'utilitza per a productes d'ambientació i, com molts olis essencials, s'utilitzen olis que contenen carvones en aromateràpia i medicina alternativa. La S-(+)-carvona ha mostrat un efecte supressor contra l'augment de pes de la dieta induïda en greixos en els ratolins.[15]
Agricultura
La S-(+)-carvona també s'utilitza per evitar la germinació prematura de patates durant l'emmagatzematge, essent fins i tot més potent que el profam (isopropilfenilcarbamat) i clorprofam (isopropil-3-clorfenilcarbamat). Als Països Baixos es comercialitza amb aquesta finalitat amb el nom de Talent. També inhibeix el creixement d'alguns fongs, floridures i llevats com ara Aspergillus niger i Candida albicans.[1]
A la Unió Europea, aquesta substància activa ha estat inscrita a l'annex I de la directiva 91/414/CEE per la directiva 2008/44/CE dins el pla de reglamentació dels productes fitofarmacèutics.
Control d'insectes
S'ha proposat l'ús de la R-(−)-carvona com a repel·lent contra els mosquits i l'Agència de Protecció Ambiental dels EUA està revisant una sol·licitud per registrar-la com a pesticida.[16]
Síntesi asimètrica
La carvona està disponible en ambdues formes enantiomèricament pures a preus baixos, cosa que la converteix en un atractiu material de partida per a la síntesi total asimètrica de productes naturals. Per exemple, la S-(+)-carvona es va utilitzar per iniciar una síntesi del terpinoide quassina:[17][18]

També és un dels materials de partida en la síntesi de la picrotoxina.[1][19]
Metabolisme
Al cos, estudis in vivo indiquen que ambdós enantiòmers de carvona es metabolitzen principalment en àcid dihidrocarvònic, àcid carvònic i uroterpenolona.[20] El (-)-carveol també es forma com a producte menor mitjançant la reducció de NADPH. La (+)-carvona també es converteix en (+)-carveol.[21] Això es produeix principalment al fetge i implica el citocrom P450 oxidasa i (+)-trans-carveol deshidrogenasa.
Perillositat
La dosi letal 50 de la carvona és de 3,562 g/kg [rata, via oral], tot i que cada isòmer presenta dosis letals diferents: per a l'isòmer S, la DL50 és d'1,64 g/kg i per a l'isòmer R és de 5,4 g/kg[22]
Referències
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 De Carvalho, Carla C. C. R.; Da Fonseca, M. Manuela R. «Carvone: Why and how should one bother to produce this terpene» (en anglès). Food Chemistry, 95, 3, abril 2006, pàg. 413-422. DOI: 10.1016/j.foodchem.2005.01.003.
- ↑ 2,0 2,1 2,2 Simonsen, J. L.. The Terpenes. Volume 1: The Simple Acyclic and Monocyclic Terpenes and Their Derivatives (en anglès). 2a edició. Cambridge: Cambridge University Press, 1953, p. 394-408.
- ↑ Schweizer, Eduard «Untersuchung über das Kümmelöl (Oleum Carvi)» (en alemany). Journal für Praktische Chemie, 24, 1, 1841, pàg. 257-274. DOI: 10.1002/prac.18410240136.
- ↑ Goldschmidt, Heinrich; Robert, Zürrer «Ueber das Carvoxim» (en alemany). Berichte der Deutschen Chemischen Gesellschaft, 18, 1885, pàg. 1729-1733.
- ↑ Wagner, Georg «Zur Oxydation cyklischer Verbindungen» (en alemany). Berichte der Deutschen chemischen Gesellschaft zu Berlin, 27, 1894, pàg. 2270-2276.
- ↑ Leitereg, Theodore J.; Guadagni, Dante G.; Harris, Jean; Mon, Thomas R.; Teranishi, Roy «Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones» (en anglès). Journal of Agricultural and Food Chemistry, 19, 4, juliol 1971, pàg. 785-787. DOI: 10.1021/jf60176a035.
- ↑ Morcia, Caterina; Tumino, Giorgio; Ghizzoni, Roberta; Terzi, Valeria. «Carvone (Mentha spicata L.) Oils». A: Essential Oils in Food Preservation, Flavor and Safety (en anglès). Academic Press, 2016, p. 309-316. DOI 10.1016/B978-0-12-416641-7.00035-3. ISBN 978-0-12-416641-7.
- ↑ Laska, Matthias; Liesen, Anne; Teubner, Peter «Enantioselectivity of odor perception in squirrel monkeys and humans» (en anglès). American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 277, 4, 01-10-1999, pàg. R1098–R1103. DOI: 10.1152/ajpregu.1999.277.4.r1098. PMID: 10516250.
- ↑ Srikrishna, A.; Jagadeeswar Reddy, T. «Enantiospecific synthesis of (+)-(1S,2R,6S)-1,2-dimethylbicyclo[4.3.0]nonan-8-one and (−)-7-epibakkenolide-A» (en anglès). Tetrahedron, 54, 38, setembre 1998, pàg. 11517-11524. DOI: 10.1016/S0040-4020(98)00672-3.
- ↑ 10,0 10,1 Fahlbusch, Karl-Georg; Hammerschmidt, Franz-Josef; Panten, Johannes; Pickenhagen, Wilhelm; Schatkowski, Dietmar; BAUER, Kurt; GARBE, Dorothea; SURBURG, Horst. «Flavors and Fragrances». A: Ullmann's encyclopedia of industrial chemistry (en anglès). Sixthition, 2003. DOI 10.1002/14356007.a11_141. ISBN 978-3-527-30673-2.
- ↑ Sell, Charles S. «Terpenoids». A: Kirk‐Othmer Encyclopedia of Chemical Technology (en anglès). Hoboken (Nova Jersey): John Wiley & Sons, Inc., 2006-09-15, p. 2005181602120504.a01.pub2. DOI 10.1002/0471238961.2005181602120504.a01.pub2. ISBN 978-0-471-23896-6.
- ↑ Hornok, L. Cultivation and processing of medicinal plants (en anglès). Chichester: John Wiley & Sons, 1992.
- ↑ Rothenberger, Otis S.; Krasnoff, Stuart B.; Rollins, Ronald B. «Conversion of (+)-Limonene to (-)-Carvone: An organic laboratory sequence of local interest» (en anglès). Journal of Chemical Education, 57, 10, octubre 1980, pàg. 741. DOI: 10.1021/ed057p741.
- ↑ Sell, Charles S. A fragrant introduction to terpenoid chemistry (en anglès). Cambridge: Royal Society of Chemistry, 2003, p. 78. ISBN 0-85404-681-X.
- ↑ Alsanea, Sary; Liu, Dexi «BITC and S-Carvone Restrain High-Fat Diet-Induced Obesity and Ameliorate Hepatic Steatosis and Insulin Resistance» (en anglès). Pharmaceutical Research, 34, 11, 21-07-2017, pàg. 2241-2249. DOI: 10.1007/s11095-017-2230-3. ISSN: 1573-904X. PMID: 28733781.
- ↑ Enviromental Protection Agency «Pesticide Products; Registration Application» (PDF) (en anglès). Federal Register, 74, 41, 04-03-2009, pàg. 9396-9397 [Consulta: 1r abril 2020].
- ↑ Shing, Tony K. M.; Jiang, Qin; Mak, Thomas C. W. «Total Synthesis of (+)-Quassin from (+)-Carvone» (en anglès). J. Org. Chem, 63, 7, 1998, pàg. 2056-2057. DOI: doi.org/10.1021/jo9718962.
- ↑ Shing, Tony K. M.; Tang, Ying «Synthesis of optically active tetracyclic quassinoid skeleton» (en anglès). J. Chem. Soc., Perkin Trans. 1, 12, 1994, pàg. 1625-1631. DOI: doi.org/10.1039/P19940001625.
- ↑ Ikan, Raphael. Selected topics in the chemistry of natIkural products (en anglès). Singapur: World Scientific, 2008, p. 167. ISBN 981-279-078-0.
- ↑ Engel, Wolfgang «In Vivo Studies on the Metabolism of the Monoterpenes S-(+)- and R-(−)-Carvone in Humans Using the Metabolism of Ingestion-Correlated Amounts (MICA) Approach» (en anglès). Journal of Agricultural and Food Chemistry, 49, 8, agost 2001, pàg. 4069-4075. DOI: 10.1021/jf010157q. PMID: 11513712.
- ↑ Jäger, Walter; Mayer, M.; Platzer, P.; Reznicek, G.; Dietrich, H.; BUCHBAUER, G «Stereoselective metabolism of the monoterpene carvone by rat and human liver microsomes.» (en anglès). Journal of pharmacy and pharmacology, 52, 2, febrer 2000, pàg. 191-197. DOI: 10.1211/0022357001773841. PMID: 10714949.
- ↑ Bruneton, Jean. Pharmacognosie, Phytochimie, Plantes médicinales (en francès). 5a edició. Lavoisier Tec & Doc, 2016, p. 757. ISBN 978-2743021658.
Enllaços externs
- Carvona a The Periodic Table of Videos (Universitat de Nottingham) (anglès)

















