Informatics Educational Institutions & Programs
Conteúdo
Carbonilação refere-se a reações químicas que introduzem monóxido de carbono em substratos orgânicos e inorgânicos. Monóxido de carbono é abundantemente disponível e convenientemente reativo, e assim é largamente usado como reagente na indústria química.
Reações de carbonilação são reações químicas que incorporam monóxido de carbono (CO) a moléculas orgânicas como álcoois ou alcenos[1].São parte importante da área de catálise homogênea, tendo ampla aplicação industrial. Utilizam catalisadores à base de metais de transição como cobalto, ródio, irídio e paládio.
Os produtos industriais de maior impacto econômico da carbonilação são o ácido acético (carbonilação do metanol) e o anidrido acético (carbonilação do acetato de metila). Esse último é matéria prima do acetato de celulose, usado na produção de plásticos e revestimentos, entre outros[2]. A carbonilação também é relevante no ramo da química fina[1] e da farmacêutica[3]. Reações de carbonilação também estão envolvidas na produção de fármacos como o Ibuprofeno[3],[4] e na produção de insumos como metil metacrilato e ácido acrílico[2].
Reações de carbonilação são importantes por oferecer alternativas mais limpas e de maior eficiência atômica para a síntese de algumas moléculas originalmente fabricadas por métodos estequiométricos com insumos tóxicos. Alguns dos desafios associados à carbonilação são as condições de reação, a separação do catalisador do produto e, no caso de ciclos catalíticos à base de ródio, a retenção do catalisador em fase homogênea[3].
Histórico
Em 1913 descobriu-se a produção de ácido acético via carbonilação do metanol, utilizando iodeto de cobalto como catalisador. Já na década de 60, a BASF operava uma pequena planta de carbonilação do metanol com o método via cobalto. O processo precisa de alta pressão e alta temperatura (≥ 500 bar, ~230°C) e tem seletividade moderada; além disso, resulta em subprodutos indesejáveis como etanal, etanol e ácido propanoico[2].
Nos anos 70, a Monsanto comercializou o processo com catálise via ródio. As condições do processo são mais brandas (≥ 30 bar, ~180°C) e a seletividade é maior. Entretanto, embora o processo seja eficiente e possua alta seletividade, é necessário operar em condições rigorosas para evitar a perda do ródio através da precipitação de RhI3[2].
Na década seguinte, em 1983, a Eastman desenvolveu um processo de carbonilação do acetato de metila, produzindo anidrido acético com o uso de ródio como catalisador[3][5].
Em 1996, a BP lançou o Cativa®, processo de carbonilação do metanol utilizando catalisador à base de irídio. O processo à base de irídio opera em condições similares às do processo Monsanto, mas com algumas vantagens - como a possibilidade de trabalhar com pressões parciais de CO mais baixas e com menor teor de água[2].
Atualmente, os estudos envolvendo a carbonilação visam obter maior atividade e maior seletividade, além de desenvolver métodos ainda mais limpos do ponto de vista ambiental[6].
Produção de Anidrido Acético a partir do Acetato de Metila
A obtenção de anidrido acético por carbonilação catalítica do acetato de metila é o principal meio de produção deste composto químico. Além dele, o mesmo ciclo catalítico pode ser empregado usando dimetil-éter em vez de acetato de metila. Ainda, outra rota é um processo via reação entre cetena e ácido acético, embora este esteja em declínio[7].
O processo Eastman é o método mais bem estabelecido, e consiste na carbonilação do acetato de metila utilizando catalisador de ródio, com um ciclo auxiliar que envolve sais de lítio e ácido iodídrico (HI). Foi desenvolvido entre as décadas de 70 e 80, em função da crise do petróleo na época, que direcionou os esforços da indústria química para outras fontes de substâncias orgânicas. No caso do processo Eastman, seu desenvolvimento foi importante, pois abriu caminho ao carvão como precursor químico e não apenas como fonte de calor, além de ter sido o pioneiro nos processos de destilação reativa, para obtenção do acetato de metila[2].
Tem dois ciclos concomitantes, e aquele que envolve o ródio tem uma semelhança muito grande com o da obtenção do ácido acético a partir do metanol (Processo Monsanto)[8]. Entretanto, diferente do Processo Monsanto, é necessário um meio reacional anidro, garantindo que o anidrido acético não reagirá com água sofrendo hidrólise, o que levaria à formação de ácido acético[7].
O processo industrial ocorre a altas temperaturas (entre 160 °C e 220 °C) e altas pressões de CO (300 a 1200 psi), a fim de deslocar o equilíbrio para formação de produtos e aumentar o rendimento do processo porque a energia livre da reação é bastante baixa[8]. Em geral o meio reacional são os próprios reagentes, com uma concentração do catalisador de ródio na ordem de 500 a 1000 ppm[9].
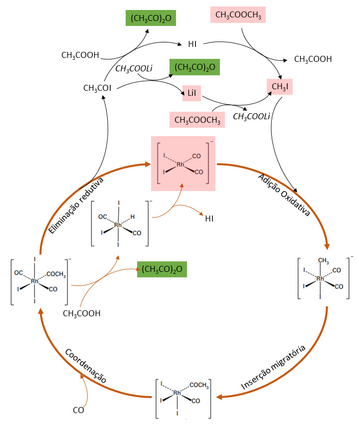
A reação é representada na figura ao lado, em que o ciclo inorgânico é destacado em laranja, os reagentes em vermelho e o produto em verde.
O complexo [Rh(CO)2I2]- é o catalisador da reação, ao qual se adiciona o iodeto de metila (CH3I), e que irá formar o grupo acetil, que na última etapa do ciclo inorgânico reage com ácido acético (se presente) formando o anidrido acético.
Conforme proposto inicialmente pelos pesquisadores que desenvolveram o processo, a rota principal de formação do produto começa na última etapa do ciclo inorgânico, com a junção do grupo acetil com o iodeto (I-), ambos ligados ao ródio, regenerando o catalisador e formando iodeto de acetila (CH3COI) - etapa de eliminação redutiva. Em quantidades suficientes de lítio presentes no meio reacional (de 1500 a 4000 ppm[9]), o iodeto de acetila reage rapidamente com ácido acético ou acetato de lítio para formar o anidrido acético. A presença de lítio é o ponto chave do processo Eastman, e o que diferencia-o mais fortemente do processo Monsanto, pois este metal faz com que a formação do iodeto de metila, essencial para o início do ciclo catalítico do ródio, seja mais rápida, além de propiciar rotas muito mais rápidas para a formação do produto de interesse a partir do CH3COI formado, tornando o próprio ciclo catalítico a etapa lenta do processo, e não a formação do produto em si, ou seja, a velocidade da reação passa a depender apenas das concentrações do catalisador [Rh(CO)2I2]- e do iodeto de metila[8]. Sem o lítio, o processo industrial seria economicamente inviável.
A escolha do ródio como catalisador é devida às condições menos severas que este metal requer quando comparado com níquel, cobalto ou outros metais tipicamente empregados. Já o emprego do lítio frente a outros cátions é porque é o caso em que a menor concentração já permite obter um ciclo auxiliar suficientemente rápido, mantendo a concentração de iodeto de metila elevada e auxiliando na formação de anidrido acético. Íons de outros metais precisariam ser empregados em concentrações muito elevadas, inclusive em limites não praticáveis[8].
Um outro parâmetro importante do processo Eastman é que requer a adição de hidrogênio ao meio reacional, em torno de 5% da pressão de CO empregada. Fazendo isso, garante-se uma atmosfera suficientemente redutora que manterá o catalisador de ródio na forma desejada ([Rh(CO)2I2]-) e não em outros arranjos possíveis, como [Rh(CO)2I4]-, que são inertes na reação desejada[8].
É interessante observar ainda que o acetato de metila pode ser obtido a partir da esterificação do metanol com ácido acético. Este último, por sua vez, pode ser obtido da carbonilação do metanol, o qual pode ser oriundo do gás de síntese (CO + H2). Assim, o anidrido acético pode ter o CO como única fonte de carbono, a depender da rota de síntese[7][2].
Referências
- ↑ a b Haynes, A. (1 de janeiro de 2013). Reedijk, Jan; Poeppelmeier, Kenneth, eds. «6.01 - Carbonylation Reactions». Amsterdam: Elsevier: 1–24. ISBN 978-0-08-096529-1. Consultado em 24 de fevereiro de 2024
- ↑ a b c d e f g Bhaduri, Sumit; Mukesh, Doble (5 de setembro de 2014). Homogeneous Catalysis: Mechanisms and Industrial Applications (em inglês) 1 ed. [S.l.]: Wiley
- ↑ a b c d Kelkar, A. A. (1 de janeiro de 2016). Joshi, Sunil S.; Ranade, Vivek V., eds. «Chapter 14 - Carbonylations and Hydroformylations for Fine Chemicals». Amsterdam: Elsevier: 663–692. ISBN 978-0-12-801457-8. Consultado em 24 de fevereiro de 2024
- ↑ «Green Chemistry in the Pharmaceutical Industry | Wiley». Wiley.com (em inglês). Consultado em 24 de fevereiro de 2024
- ↑ Zoeller, Joseph R. (28 de fevereiro de 2009). «Eastman Chemical Company's "Chemicals from Coal" program: The first quarter century». Catalysis Today. Catalysis and Chemistry for the Synthesis of Fuels, Chemicals and Petrochemicals (3): 118–126. ISSN 0920-5861. doi:10.1016/j.cattod.2008.10.005. Consultado em 24 de fevereiro de 2024
- ↑ Gabriele, Bartolo (1 de janeiro de 2018). Solé, Daniel; Fernández, Israel, eds. «Chapter 3 - Synthesis of Heterocycles by Palladium-Catalyzed Carbonylative Reactions». Academic Press: 55–127. ISBN 978-0-12-811651-7. Consultado em 24 de fevereiro de 2024
- ↑ a b c «ACETIC ANHYDRIDE». Ataman Kimya (em turco). Consultado em 18 de fevereiro de 2024
- ↑ a b c d e Zoeller, Joseph R.; Agreda, Victor H.; Cook, Steven L.; Lafferty, Norma L.; Polichnowski, Stanley W.; Pond, David M. (11 de março de 1992). «Eastman chemical company acetic anhydride process». Catalysis Today (1): 73–91. ISSN 0920-5861. doi:10.1016/0920-5861(92)80188-S. Consultado em 18 de fevereiro de 2024
- ↑ a b «Preparation of Acetic Anhydride». Google Patents. 15 de fevereiro de 1983. Consultado em 18 de fevereiro de 2024

















